Cuando los signos clínicos en la granja y las lesiones observadas en los lechones nos hacen sospechar de una infección por Haemophilus parasuis (ver capítulo "Diagnóstico clínico y patológico") tendremos que confirmar este diagnóstico en el laboratorio.
 |
|
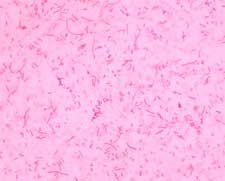
Fig. 1 Tinción de Gram de Haemophilus parasuis. Se observan bacilos gram negativos cortos y otros más alargados (pleomórfico).
|
Desde que Glässer encontró la asociación entre un bacilo y las lesiones de poliserositis en lechones, pasaron 32 años hasta que Hjärre y Wramby lograron su aislamiento en el laboratorio en 1943. Desde entonces, el aislamiento de Haemophilus parasuis a partir de las lesiones características de la enfermedad de Glässer es la técnica concluyente o "gold standard" para el diagnóstico de esta enfermedad. Sin embargo, H. parasuis es una bacteria lábil, con requerimientos complejos para crecer en el laboratorio y cuyo aislamiento en cultivo puro puede resultar difícil. Para incrementar las posibilidades de éxito en el aislamiento de esta bacteria es esencial contar con las muestras apropiadas, tomadas evitando contaminaciones y transportadas adecuadamente.
Las muestras deben tomarse de animales con presentación aguda de la enfermedad, principalmente con signos de distrés respiratorio o artritis, pero también de aquellos con signos nerviosos. A ser posible, se elegirán animales que no hayan sido tratados con antibióticos. Los animales afectados de forma crónica no son apropiados, ya que de sus lesiones crónicas (poliserositis fibrosa) no se aísla la bacteria. Las muestras deben tomarse de lesiones sistémicas (pericarditis, artritis, peritonitis,…) con la ayuda de hisopos o recogiendo muestras de los líquidos acumulados en las distintas cavidades. En animales con síntomas nerviosos también se puede tomar una muestra de líquido cefalorraquídeo. Las muestras de pulmón no son apropiadas para el diagnóstico de la enfermedad de Glässer y deben ser usadas cuando los animales presenten únicamente neumonía. Esto es debido a que H. parasuis es un colonizador del tracto respiratorio superior de los lechones y la presencia de la bacteria en el pulmón puede ser debida a una invasión post-mortem desde la nariz. De este modo se aislaría una cepa de H. parasuis que realmente no estaría implicada en la enfermedad. Por este mismo motivo no se pueden usar muestras nasales o tonsilares en el diagnóstico. Para aumentar las posibilidades de supervivencia de la bacteria, las muestras deben ser transportadas al laboratorio lo antes posible (mejor antes de 2 días) y en medio Amies con refrigeración.

 |
|
Fig. 2 Crecimiento de Haemophilus parasuis en cultivo puro en una placa de agar chocolate.
|
H. parasuis es un bacilo gram-negativo de la familia Pasteurellaceae, que requiere NAD para crecer. Así, en el laboratorio crece en agar chocolate (fig. 2) o en agar sangre con una estría de Staphylococcus que le proporciona el NAD. H. parasuis crece lentamente y necesita 1-3 días para producir colonias pequeñas. La identificación de H. parasuis debe incluir la diferenciación de bacterias similares, como Actinobacillus minor, Actinobacillus indolicus y Actinobacillus porcinus. Esta diferenciación es importante porque estos Actinobacillus también pueden ser aislados del tracto respiratorio de las cerdos y, aunque se consideran poco o nada patogénicos, se han aislado en cultivo puro de pulmones neumónicos, e incluso de lesiones sistémicas en el caso de A. porcinus. La diferenciación puede realizarse mediante pruebas bioquímicas, específicamente producción de indol y actividades ureasa y catalasa.
Tabla 1. Diferenciación de Haemophilus parasuis y Actinobacilus minor, A. indolicus y A. porcinus mediante pruebas bioquímicas.
|
H. parasuis
|
A. minor
|
A. indolicus
|
A. porcinus
|
|
| Catalasa |
+
|
-
|
+
|
-
|
| Indol |
-
|
-
|
+
|
-
|
| Ureasa |
-
|
+
|
-
|
-
|
 |
|
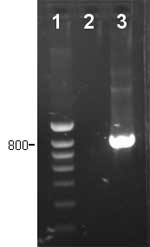
Fig. 3 PCR específica para detección de Haemophilus parasuis.
1: marcador de peso molecular. 2: muestra negativa, no se detectó H. parasuis. 3: muestra positiva, lesión producida por H. parasuis. |
La introducción de la PCR en el diagnóstico de las enfermedades infecciosas supuso una ventaja en el diagnóstico de microorganismos de difícil cultivo o crecimiento muy lento. En el caso de H. parasuis la PCR más utilizada es la publicada por Oliveira y colaboradores en 2001. Esta técnica puede sustituir la identificación bioquímica de los aislamientos bacterianos o usarse directamente en muestras clínicas. En éste último caso, esta PCR tiene una sensibilidad de 102 CFU/mL. Como para el caso del aislamiento, las muestras nasales o tonsilares no son adecuadas para el diagnóstico. En los casos en los que no se pueda realizar el aislamiento, por ejemplo por tener un número excesivo de muestras, esta PCR específica puede ayudar en el diagnóstico (fig. 3). Sin embargo, el disponer del aislamiento bacteriano permite realizar pruebas adicionales, como la susceptibilidad a antimicrobianos o el tipado, que ayudan en el control de la enfermedad.



