Introducción
En un sistema de producción comercial, los cerdos están continuamente expuestos a varios patógenos y virus. La exposición crónica a infecciones clínicas o subclínicas compromete la función de la barrera intestinal y activa una respuesta sistémica que reduce la tasa de deposición de proteínas y la eficiencia del crecimiento. La respuesta sistémica afecta al rendimiento de los cerdos de dos maneras: altera la partición de nutrientes y produce respuestas neurológicas a la infección inducidas por eicosanoides (por ejemplo, anorexia). En este artículo se revisará el papel de la nutrición como atenuante de la reducción del rendimiento causada por la activación del sistema inmunitario.

Satisfacer las necesidades alteradas de aminoácidos
La activación del sistema inmunológico reduce la eficiencia alimentaria al alterar la partición de nutrientes. La liberación de citoquinas pro y antiinflamatorias estimula el hígado y aumenta la captación hepática de aminoácidos para producir moléculas relacionadas con la inmunidad (Breuille et al., 1994; 1998). En la musculatura esquelética de cerdos y ratas inmunoactivados, es evidente un catabolismo aminoacídico significativo, que depende de la gravedad y la duración de la inflamación (Breuille et al., 1994; 1998; Williams et al., 1997a; 1997b). Rakhshandeh y de Lange, 2011, publicaron una revisión exhaustiva sobre el papel de cada aminoácido en la deposición total de proteína en cerdos con el sistema inmunológico activado. En resumen, pese a un aumento de la demanda metabólica de glutamina, arginina, fenilalanina, tirosina y de aminoácidos de cadena ramificada durante una activación moderada del sistema inmune, los requerimientos no aumentaron debido a que la síntesis de novo o el aporte de la dieta eran suficientes para cubrirlos. Aunque disponemos de una información muy limitada, se cree que los requerimientos de treonina pueden verse incrementados si se estimula la producción de moco o de inmunoglobulinas ricas en treonina durante la activación del sistema inmune ya que la treonina es el principal aminoácido del moco y de algunas inmunoglobulinas (Faure et al., 2007; Rakhshandeh y de Lange, 2011). Usando una inyección intramuscular de un lipopolisacárido (LPS) de E. coli, se demostró que los requirimientos de triptófano aumentaron un 7% en cerdos en crecimiento inmunoactivados (de Ridder et al., 2012). Se sabe que los requerimientos de los aminoácidos sulfurados (AAS), especialmente la cisteína, aumentan en los cerdos inmunoactivados. Recientemente se han llevado a cabo estudios en lechones destetados y cerdos de engorde con modelos de infección por E. coli y por inyección de LPS, respectivamente, para reproducir el nivel de inmunoactivación de granjas comerciales, donde se producen desafíos crónicos por patógenos y virus (ver figuras 1 y 2). Estos estudios demostraron que, en comparación con los cerdos sanos, la tasa de la deposición total de proteínas en los inmunoactivados se redujo un 12% en dietas con los valores recomendados para AAS (NRC, 2012) y la máxima deposición proteica sólo se alcanzó al suplementar los AAS un 20% por encima de las recomendaciones actuales de la NRC (relación SAA:Lys de 0,75; Kim et al., 2012).
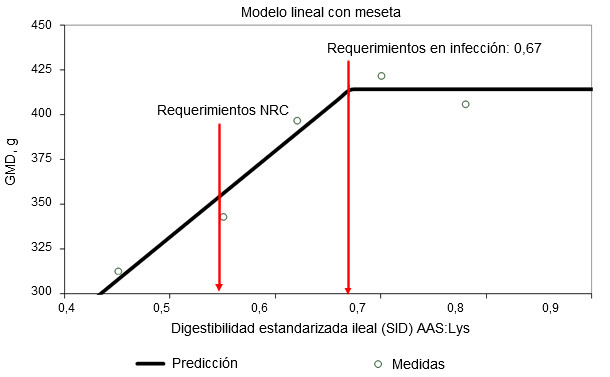
Figura 1. Requerimientos de digestibilidad ileal estandarizada para aminoácidos sulfurados determinados en lechones destetados infectados oralmente con una cepa enterotoxigénica de E. coli (Capozzalo et al., datos sin publicar)
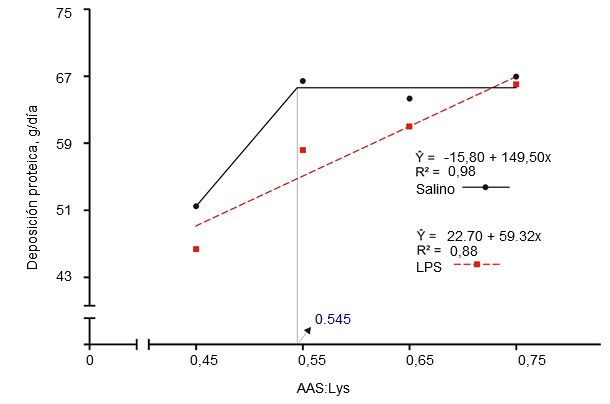
Figura 2. Requerimientos de digestibilidad ileal estandarizada para aminoácidos sulfurados determinados en cerdos de engorde a los que se había inyectado intramuscularmente una solución salina o lipopolisacárido (LPS) de E. coli (Kim et al., 2012)
Manipulando la ruta de los eicosanoides
Uno de los efectos más importantes de la estimulación del sistema inmune es el aumento de la producción de eicosanoides como la prostaglandina E2 (PGE2) y el leucotrieno B4 (LTB4), que inducen la anorexia asociada a infecciones (Wymann y Schneiter, 2008) y controlan la duración de la inflamación, respectivamente (Devchand et al., 1996). La producción de mediadores eicosanoides en la célula y las membranas nucleares se inicia mediante la acción de la fosfolipasa A2 o C que convierten, respectivamente, los fosfolípidos y diacetilgliceroles de la membrana a ácidos araquidónicos. Los ácidos araquidónicos son convertidos a su vez en en PGE2 o LTB4 por la ciclooxigenasa y la lipoxigenasa, respectivamente (Folco and Murphy, 2006; Wymann and Schneiter, 2008; Kalinski 2012). Se sabe que los ácidos grasos Omega-3 reducen competitivamente la producción de eicosanoides proinflamatorios actuando como sustratos para las enzimas ciclooxigenasa y lipooxigenasa, mientras que los antioxidantes, como la vitamina E y el selenio, reducen el daño tisular atenuando las especies reactivas del oxígeno asociadas a la fagocitosis. La suplementación con boro reduce la respuesta inflamatoria al unirse a las proteasas producidas durante la fagocitosis (el mecanismo detallado puede encontrarse en Kim et al., 2013).
Conclusión
Los cerdos alojados en una explotación comercial están expuestos, de un modo consistente, a infecciones (sub) clínicas y factores de estrés y las respuestas sistémicas frente a estos desafíos reducen significativamente el potencial de crecimiento de los cerdos. La respuesta inmune sistémica afecta al rendimiento del cerdo en dos formas diferentes: alteración de la partición de nutrientes y respuestas neurológicas a la infección, como la anorexia. Como posibles soluciones se sugiere la suplementación de los aminoácidos que son más utilizados durante la respuesta sistémica para contrarrestar la alteración de la partición de nutrientes y la suplementación de nutrientes que reducen la producción de mediadores eicosanoides que, a su vez, provocan una respuesta neurológica a la infección.

*Algunos aspectos de este artículo fueron publicados originalmente en “Impact of the systemic response to stressors and subclinical and clinical infection on intestinal barrier function and growth in pigs” en “Manipulating Pig Production XIV (eds. J.R. Pluske and J.M. Pluske), pp. 62-76, Australasian Pig Science Association.




